





Les structures de Lewis représentent les électrons de la dernière couche occupée d'un atome ou d'un ion:
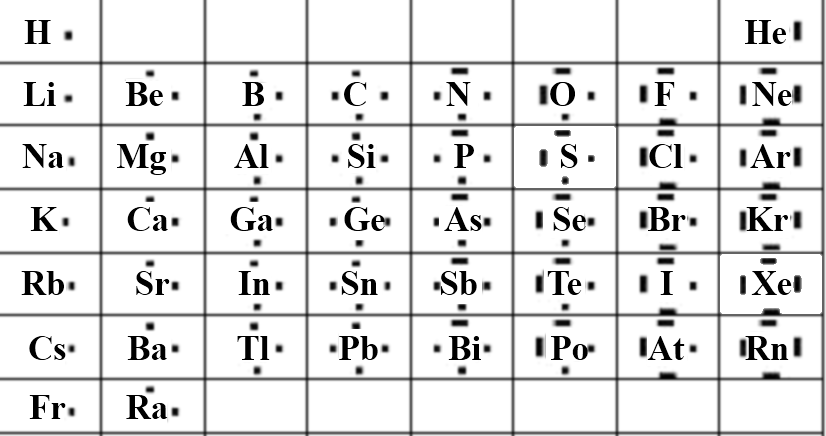
S'il possède dans la dernière couche le nombre d'électrons que dans sa structure de Lewis, l'atome est neutre, s'il en a n fois plus (moins), il devient un ion possèdant n charges négatives (positives), par exemple $O^{2-}$ possède 6+2= 8 $e^-$ dans la dernière couche.
Pour chaque atome, on compte:
- deux électrons pour chacun de ses doublets propres.
- un électron pour chaque liaison covalente.
Comme en haut on en déduit la charge, par exemple:
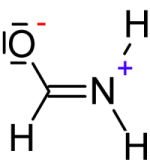 - À chaque atome $H$, on attribue $1\; e^-$ (celui de la seule liaison covalente qu'il forme), donc la charge formelle est chaque fois égale à $0$
- À l'atome $C$, on attribue $4\; e^-$ (ceux des 4 liaisons covalentes qu'il forme), donc la charge formelle est égale à $0$
- À l'atome $O$, on attribue $7\; e^-$ (ceux des 3 doublets propres et celui de la liaison covalentes qu'il forme), donc la charge formelle est égale à $-1$
- À l'atome $N$, on attribue $4\; e^-$ (ceux des 4 liaisons covalentes qu'il forme), donc la charge formelle est égale à $+1$
- À chaque atome $H$, on attribue $1\; e^-$ (celui de la seule liaison covalente qu'il forme), donc la charge formelle est chaque fois égale à $0$
- À l'atome $C$, on attribue $4\; e^-$ (ceux des 4 liaisons covalentes qu'il forme), donc la charge formelle est égale à $0$
- À l'atome $O$, on attribue $7\; e^-$ (ceux des 3 doublets propres et celui de la liaison covalentes qu'il forme), donc la charge formelle est égale à $-1$
- À l'atome $N$, on attribue $4\; e^-$ (ceux des 4 liaisons covalentes qu'il forme), donc la charge formelle est égale à $+1$
Il arrive souvent que pour des raisons de facilité, on ne représente pas les doublets propres, par exemple:
 - L'atome $O$ en haut possède évidemment 2 doublets et il forme 2 liaisons covalentes, donc sa charge formelle est égale à $0$
- L'atome $O$ en bas possède évidemment 3 doublets et il forme 1 liaison covalente, donc sa charge formelle est égale à $-1$
- L'atome $C$ central forme 4 liaisons covalentes, donc sa charge formelle est égale à $0$
- L'atome $C$ en bas à droite forme 4 liaisons covalentes (une représentée, les trois autres avec des atomes $H)$, donc sa charge formelle est égale à $0$
- L'atome $O$ en haut possède évidemment 2 doublets et il forme 2 liaisons covalentes, donc sa charge formelle est égale à $0$
- L'atome $O$ en bas possède évidemment 3 doublets et il forme 1 liaison covalente, donc sa charge formelle est égale à $-1$
- L'atome $C$ central forme 4 liaisons covalentes, donc sa charge formelle est égale à $0$
- L'atome $C$ en bas à droite forme 4 liaisons covalentes (une représentée, les trois autres avec des atomes $H)$, donc sa charge formelle est égale à $0$