





Seife ist ein Carbonsärensalz, welches löslich ist. Die Carboxylate haben eine lange Kohlenwasserstoffkette die wenig polar ist, weil der Unterschied in Elektronegativität zwischen C und H gering ist. Dagegen weist die ionische Carboxylatgruppe starke Elektronegativitätsunterschiede aus und ist stark polar:
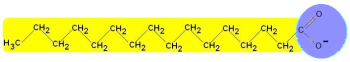
Das Carboxylation besitzt einen hydrophilen (polaren, wasserliebenden) Kopf und einen langen hydrophoben (nicht polaren, wasserfürchtenden) Schwanz
Die Wasserspinne bewegt sich auf dem Wasser, weil die Wasseroberfläche wie eine Membran gedehnt ist:

Aufgrund der starken Dipol-Dipol-Anziehungen werden die Wassermoleküle an der Oberfläche angespannt und bilden so eine Art Membran, während sich diese Kräfte im Wasserkörper ausgleichen.
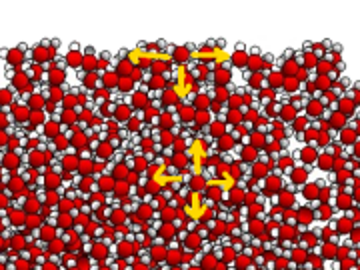
Oberflächenspannung hält Münzen auf der Wasseroberfläche. Flüssigseife wird hinzugefügt. Sehen Sie, was geschieht:
Angepasst von einem Produktion aus → Berkeley Lab
Die Carboxylationen der Seife orientieren sich an der Oberfläche mit ihrem hydrophilen Ende in Richtung Wasser. Es stellt somit eine Membran dar, die von den hydrophoben Schwänzen gebildet wird, deren gegenseitige Anziehung sehr schwach ist. Die Oberflächenspannung wird gesenkt. Die Wasserspinnen konnten nicht auf Seifenwasser laufen !

Seife ist ein Tensid
Hier ist Magermilch unter dem Mikroskop:
Die Emulsion wird aus (unpolaren) Lipidblasen gebildet, die von Carboxylationen umgeben sind, wobei ihre hydrophoben Schwänze in das Lipid eingetaucht sind. Da sich die hydrophilen Köpfe durch ihre negativen Ladungen abstoßen, bleibt die Emulsion stabil.
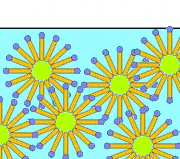
Seife ist ein Emulgator
Ein fettiger Fleck verunreinigt einen Stoff.

So lösen ihn die Carboxylat-Ionen der Seife und tragen ihn in Lösung, bereit zum Waschen:
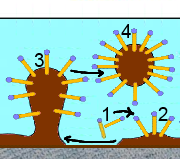
Die Seife wäscht
Seifenblasen haben eine überraschend lange Lebensdauer.

Dies liegt daran, dass eine Doppelschicht aus Carboxylationen einen dünnen Wasserstrahl stabilisiert, wobei die hydrophilen Köpfe offensichtlich in Richtung Wasser gerichtet sind!
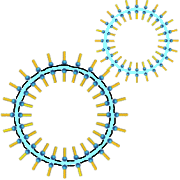
Die Seife schäumt