





Der pH -Wert einer verdünnten wässrigen Ethanollösung beträgt 7. Ethanol hat wenig sauren oder basischen Charakter, der durch pH-Messungen nachgewiesen werden kann. Deshalb wird Ethanol manchmal als Lösungsmittel für pH-Indikatoren verwendet (zB für Phenolphthalein!)
In der Arrheniustheorie der Säuren und Basen ist jede chemische Spezies, die ein $ H^+ $ - Ion verliert, eine Säure, diejenige, die eines gewinnt, ist eine Base:
Bei der Reaktion mit Natrium wird manchmal davon ausgegangen, dass die Alkohole $ H^+ $ der OH- Hydroxylgruppe verlieren. Dieses $ H^+ $ würde dann verwendet werden, um Natrium zu $ Na^+ $ zu oxidieren. Alkohol wäre somit eine Säure:
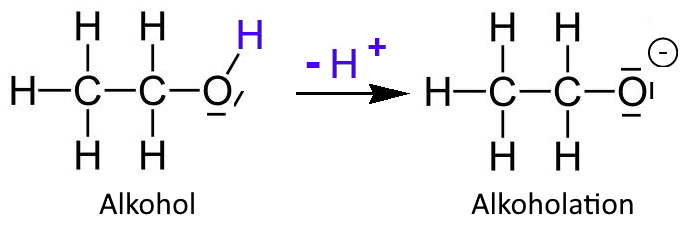 In der Reaktion mit Schwefelsäure binden sich $H^+ $ - Ionen aus der Säure an den Sauerstoff der OH-Hydroxylgruppe des Alkohols. Die Reaktion gibt Wärme ab. Alkohol wäre somit eine Base:
In der Reaktion mit Schwefelsäure binden sich $H^+ $ - Ionen aus der Säure an den Sauerstoff der OH-Hydroxylgruppe des Alkohols. Die Reaktion gibt Wärme ab. Alkohol wäre somit eine Base: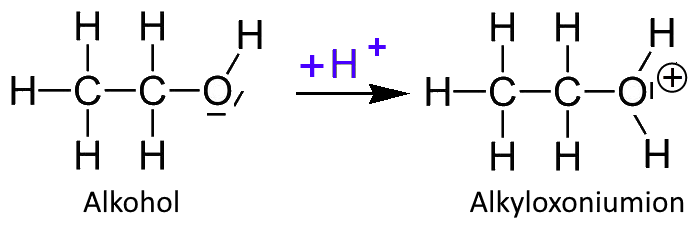
- Der + I-Effekt der Kohlenwasserstoffkette erhöht die Elektronendichte zwischen $ O $ und $ H $ und verringert die Abgangswahrscheinlichkeit von $ H^+ $. Je länger oder verzweigter die Kette ist, desto stärker ist der Effekt, desto weniger sauer ist der Alkohol.
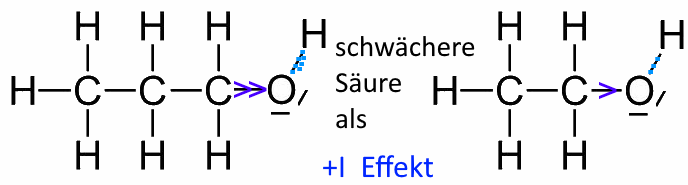 Propan-1-ol ist daher weniger sauer als Ethanol (wenn wir überhaupt in diesen beiden Fällen von Acidität sprechen können !)
- Die Alkoholationen sind die konjugierten Basen von Alkoholen. Je stabiler sie sind, desto größer ist die Tendenz zu ihrer Bildung und desto stärker sauer ist der entsprechende Alkohol .
Propan-1-ol ist daher weniger sauer als Ethanol (wenn wir überhaupt in diesen beiden Fällen von Acidität sprechen können !)
- Die Alkoholationen sind die konjugierten Basen von Alkoholen. Je stabiler sie sind, desto größer ist die Tendenz zu ihrer Bildung und desto stärker sauer ist der entsprechende Alkohol .
 Das Phenol hat einen stark sauren Charakter, da das Phenolat durch Mesomerie stabilisiert wird, während das Cyclohexanol keinen ausgeprägten sauren Charakter hat.
Das Phenol hat einen stark sauren Charakter, da das Phenolat durch Mesomerie stabilisiert wird, während das Cyclohexanol keinen ausgeprägten sauren Charakter hat.