







Spontanéité des réactions La variation de l'→ enthalpie libre de Gibbs détermine, si une réaction est spontanée ou non.
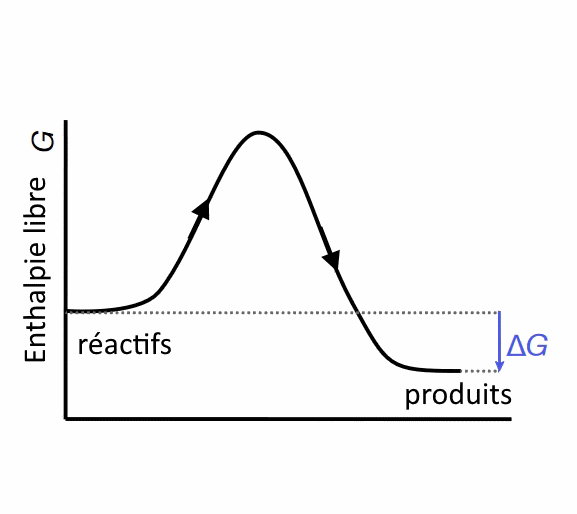
Dans ce cas, la différence d'énergie libre de Gibbs $\Delta\; G$ entre produits et réactifs et produits est négative. La réaction est donc spontanée, mais cela ne veut pas dire qu'elle est rapide!
Vitesse des réactions, énergie d'activation La vitesse d'une réaction spontanée dépend esseniellement de la hauteur de la barrière d'énergie d'activation entre réactifs et produits.
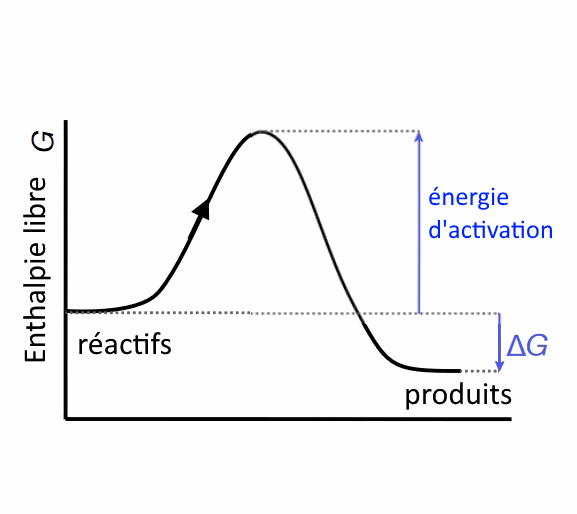
Cette barrière provient du fait qu'une réaction doit passer souvent par des intermédiaires énergétiquement peu favorables:
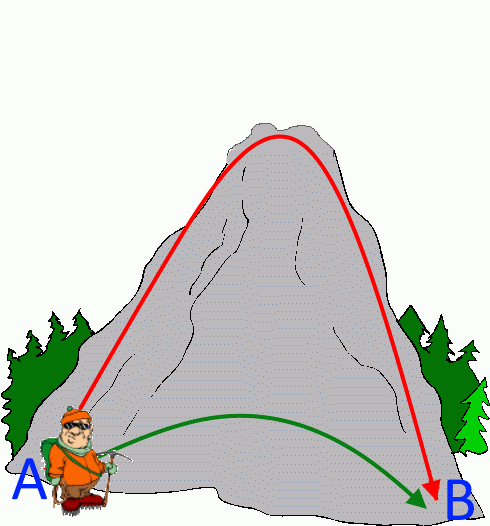
Pour aller de A en B, Pompomlamontagne a tout intérêt à emprunter la voie verte: Elle est plus rapide et il gagnera autant d'énergie que par la voie rouge!
Le catalyseur Un catalyseur réduit l'énergie d'activation en fournissant des intermédiaires moins énergétiques.
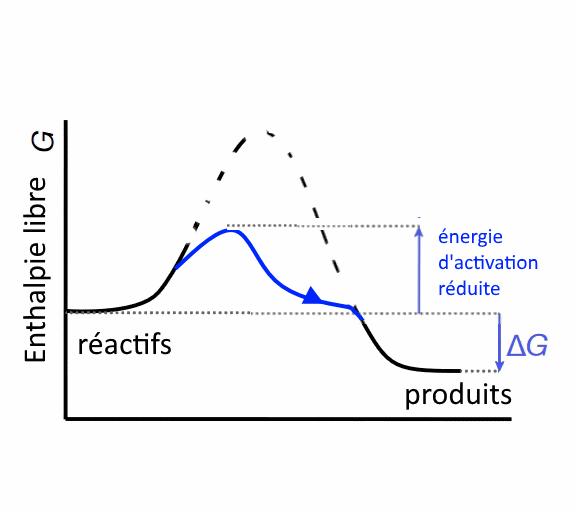
Le catalyseur accélère ainsi la réaction chimique. Un exemple simple se trouve → ici. En biochimie, les catalyseurs s'appellent enzymes.
Lactose Le lactose est un dimère du $\beta$-galactose et du $\beta$-glucose. C'est le sucre principal du lait. Dans l'intestin son hydrolyse est catalysée par l'enzyme lactase. C'est la première étape de sa digestion

Lactase L'enzyme lactase (une $\beta$-galactoxydase ) est un polypeptide très complexe de masse molaire supérieure à 15000:
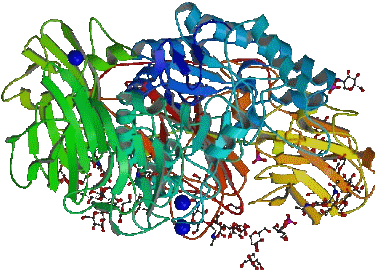
Les bandes colorées représentent des chaînes polypeptidiques.
Intolérance au lactose Un manque de lactase ( causes: génétique, lésion intestinale ou, paraît-il, un régime préalable trop privatif en produits laitiers.. ) provoque une intolérance qui se manifeste par des diarrhées, crampes, vomissements, gaz ..