





On dispose de $10,0\; cm^3$ d’une solution aqueuse d’acide méthanoïque que l’on neutralise progressivement par une solution aqueuse décimolaire d’hydroxyde de sodium.
Voici les résultats expérimentaux:
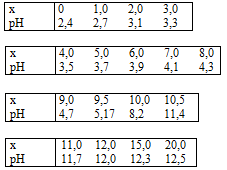
Tracer le graphique $pH = f(x)$ sur papier millimétré, puis déduire de la courbe a) une valeur approchée de la molarité en acide formique de la solution initiale .
b) une valeur approchée du pKa de l’acide formique.
c) les différentes espèces présentes dans la solution pour x = $6,0$ $ cm^3$ et leur molarité. .