





Par la suite nous désignons par $x$ le volume (en $mL$) de $HCl$ déjà ajouté.
$c_B$ = $\frac{c_{Α}V_{Α}}{V_B}$ = $\frac{0,05\cdot 0,040}{0,020}$ = $0,10 \frac{mol}{L}$
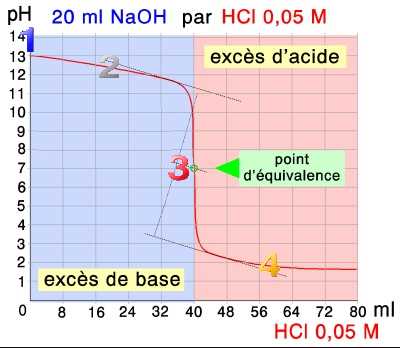
1.
La base forte $NaOH$ est seule présente, sa concentration vaut $c_B=0,10 \;M$ $pH=14+logc_B$ = $13$
2.
(pour simplifier, nous considérons les substances d'abord comme si elles n'étaient pas dissociées)
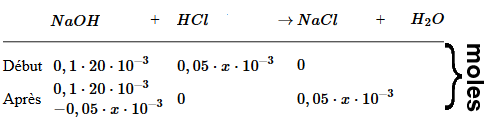
$c_{NaOH}$ = $\frac{n_{NaOH}}{(V_B+x)10^{-3}}$ = $\frac{0,1\cdot20\cdot10^{-3}-0,05\cdot x\cdot10^{-3}}{(20+x)10^{-3}}$ = $\frac{2-0,05\cdot x}{20+x}$ $pH$ $ =$ $ 14+log( \frac{2-0,05\cdot x}{20+x})$
3.
$HCl$ et $NaOH$ ont réagi entièrement, reste une solution neutre de $NaCl$: $pH = 7$
4.
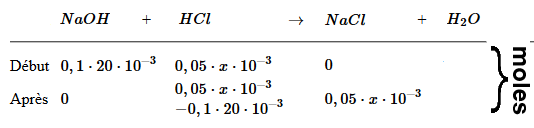
$c_{HCl}$ = $\frac{n_{HCl}}{(V_B+x)10^{-3}}$ = $\frac{0,05\cdot x\cdot10^{-3}-0,1\cdot20\cdot10^{-3}}{(20+x)10^{-3}}$ = $\frac{0,05\cdot x-2}{20+x}$ $pH$ $=$ $ -log( \frac{0,05\cdot x-2}{20+x})$
→ Voici des simulations de ces titrations