





Par sa dissociation,
$B$ $+$ $H_2O$ $\rightleftarrows$ $ OH^-$ $+$ $HB$
une base, même faible, apporte en général beaucoup plus d'ions hydroxyde dans l'eau que l'autoprotolyse de l'eau elle-même.
Appelons $n_{B}$ le nombre de moles de base $B$ introduits dans l'eau avant qu'elle ne se soit dissociée.
Si $V$ est le volume final, sa molarité initiale (formelle) s'écrit:
$c_{B}$ $=$ $\frac{n_{B}}{V}$
Appelons $x$ le nombre de moles d'hydroxyde $OH^-$ présents dans la solution au moment où l'équilibre de dissociation est atteint.
Alors on a:
$OH^-$ $=$ $ \frac{x}{V}$
et
$pOH $ $=$ $-log(\frac{x}{V})$
Déterminons $x$:
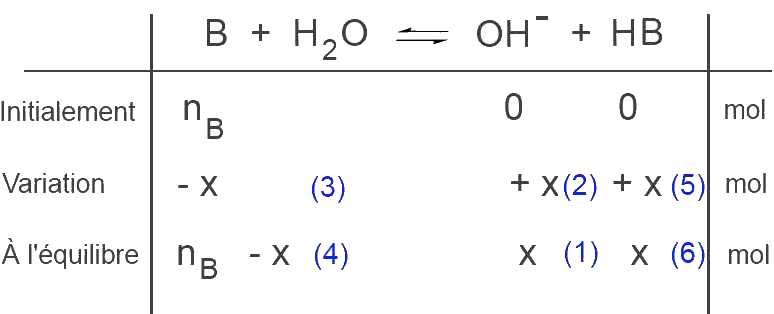 Nous trouvons dans l'ordre:
(1) $x$ moles $OH^-$ à l'équilibre
(2) $x$ moles $OH^-$ produits
(3) $x$ moles $B$ disparus
(4) $n_B-x$ moles $B$ à l'équilibre
(5) $x$ moles $HB$ produits
(6) $x$ moles $HB$ à l'équilibre
Les molarités à l'équilibre sont donc:
$[OH^-]$ $=$ $\frac{x}{V}$
$[B]$ $=$ $\frac{n_B-x}{V}$
$[HB]$ $=$ $\frac{x}{V}$
Introduisons dans l'expression de la constante de basicité $K_b$:
$K_b$ $=$ $\frac{[OH^-][HB]}{[B]}$ =
$\frac{\frac{x}{V}\frac{x}{V}}{\frac{n_B-x}{V}}$ =
$\frac{\frac{x}{V}\frac{x}{V}}{\frac{n_B}{V}-\frac{x}{V}}$ =
$\frac{[OH^-]^2}{c_B-[OH^-]}$
$[OH^-]^2+K_b[OH^-]-K_bc_B=0$
d'où, en posant $z=[OH^-]$:
Nous trouvons dans l'ordre:
(1) $x$ moles $OH^-$ à l'équilibre
(2) $x$ moles $OH^-$ produits
(3) $x$ moles $B$ disparus
(4) $n_B-x$ moles $B$ à l'équilibre
(5) $x$ moles $HB$ produits
(6) $x$ moles $HB$ à l'équilibre
Les molarités à l'équilibre sont donc:
$[OH^-]$ $=$ $\frac{x}{V}$
$[B]$ $=$ $\frac{n_B-x}{V}$
$[HB]$ $=$ $\frac{x}{V}$
Introduisons dans l'expression de la constante de basicité $K_b$:
$K_b$ $=$ $\frac{[OH^-][HB]}{[B]}$ =
$\frac{\frac{x}{V}\frac{x}{V}}{\frac{n_B-x}{V}}$ =
$\frac{\frac{x}{V}\frac{x}{V}}{\frac{n_B}{V}-\frac{x}{V}}$ =
$\frac{[OH^-]^2}{c_B-[OH^-]}$
$[OH^-]^2+K_b[OH^-]-K_bc_B=0$
d'où, en posant $z=[OH^-]$:
Pour déterminer le $pH$ d'une solution diluée de base faible: - on cherche une solution raisonnable de l'équation: $z^2$ $+$ $K_b\cdot z$ $-$ $K_b c_B$ $=0$ - on calcule $pOH$ $=$ $-log\;z$ - on trouve $pH$ $=$ $14$ $-$ $pOH$ $=$ $14$ $+$ $log\;z$
Par exemple: Soit une solution de base faible $0,10\frac{mol}{L}$ avec $K_b$ $=$ $4,00\cdot 10^{-2}$: L'équation $z^2$ $+$ $4,0\cdot 10^{-2}\cdot z$ $-$ $4,0\cdot 10^{-2}\cdot 0,10$ $=$ $0$ fournit la racine positive: $z$ $=$ $8,3\cdot 10^{-3}$ et ainsi: $pH$ $=$ $14$ $+$ $log\; z$ $ =$ $12$