





La masse volumique de la solution est le rapport de la masse de la solution par son volume: $\rho_S$ $=$ $\frac{m_S}{V_S}$
Par exemple $\rho_{S}$ $=$ $0,95\frac{g}{cm^{3}}$ veut dire que 1 $cm^3$ de la solution S a une masse de 0,9 g En effet, dans ce cas, on a: $\rho_{S}$ $=$ $\frac{0,95}{1}$ $ =$ $ 0,95\frac{g}{cm^{3}}$
Le nombre de moles du soluté est le rapport de la masse du soluté par sa masse molaire: $n_{so}$ $=$ $\frac{m_{so}}{M_{so}}$
Par exemple $18\; g$ de glucose ($C_6H_{12}O_6$) sont $n_{glucose}$ $=$ $\frac{18}{6\cdot 12+12\cdot 1+ 6\cdot 16}$ $ =$ $ 0,1 $ mol
Le pourcentage du soluté est le rapport de la masse du soluté par la masse de la solution, le tout multiplié par $100$: $\%_{so}$ $=$ $\frac{m_{so}\cdot 100}{m_S}$
Par exemple, $\%_{so}$ $=$ $24$ veut dire que $100 \;g$ de la solution S renferment $24\; g$ du soluté so En effet, dans ce cas, on a: $\%_{so}$ $=$ $\frac{24\cdot 100}{100}=24$
La molarité du soluté est le rapport du nombre de moles du soluté par le volume de la solution. $c_{so}$ $=$ $\frac{n_{so}}{V_S}$
Rappelons que nous avons convenu de désigner par $c_{so}$ la molarité formelle du soluté supposé non dissocié (avant dissociation), la molarité réelle restante après dissociation sera désignée par $[so]$: Par exemple, $c_{so}$ $=$ $2\frac{mol}{L}$ $=$ $2M$ (ne pas confondre avec la masse molaire M!) veut dire que $1\; L$ de la solution S renferment $2\; mol$ du soluté $so$ En effet, dans ce cas, on a: $c_{so}$ $=$ $\frac{2}{1}$ $=$ $2\frac{mol}{L}$
Chaque triangle coloré correspond à l'une des formules précédentes:
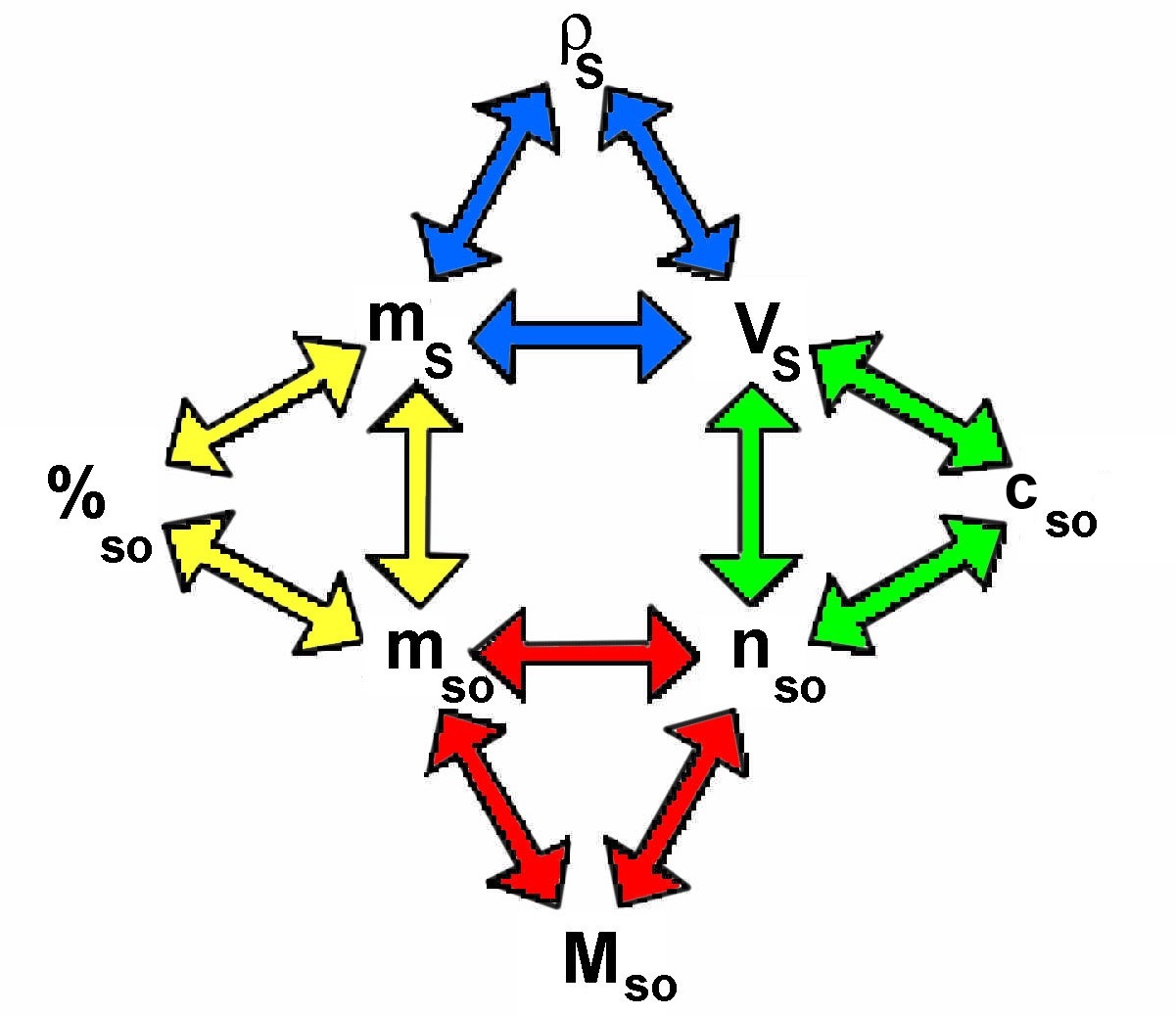 Dans chaque triangle, une grandeur peut être calculée, si on connaît les deux autres.
Le schéma permet de passer d'un triangle à l'autre.
Dans chaque triangle, une grandeur peut être calculée, si on connaît les deux autres.
Le schéma permet de passer d'un triangle à l'autre.