





- On calcule le volume de la solution-mère qu'on veut dissoudre dans le volume donné.
Par exemple, disposant d'acide chlorhydrique 1 molaire ($HCl_{conc}$), pour préparer une solution de 250 ml 0,04 molaire ($HCl_{dil}$), il faut:
$n$ $=$ $[HCl_{dil}]\cdot V$ $ = $ $0,04\cdot 0,25$ $ =$ $ 0,01 \;mol\; HCl$
soit un volume:
$v$ $=$ $\frac{n}{[HCl_{conc}]}$ $=$ $\frac{0,01}{1}$ $ = $ $0,01 \;L$ $ = $ $10\; ml \;HCl_{conc}$
- On se sert d'une pipette:
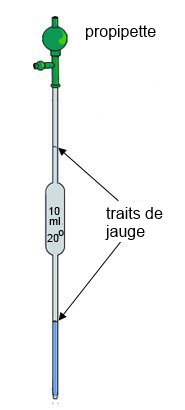 - On rince la pipette:
- On rince la pipette:
 - On prélève le volume requis:
- On prélève le volume requis:
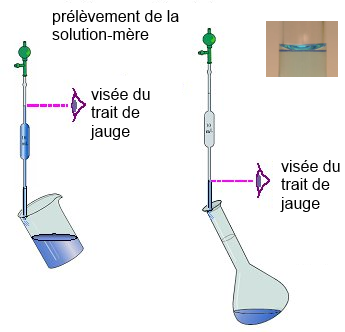 - On remplit d'eau distillée:
- On remplit d'eau distillée:
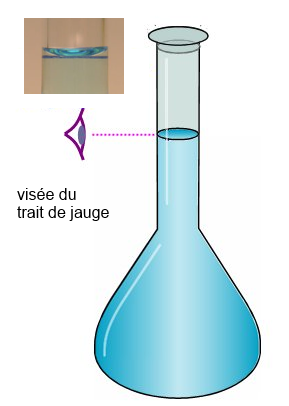
 - On vise le trait de jauge:
- On vise le trait de jauge:
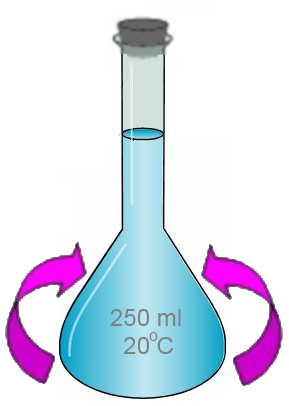
 - On bouche et on agite:
- On bouche et on agite:
 - La solution titrée (dont on connaît la molarité) est prête à l'emploi!
- La solution titrée (dont on connaît la molarité) est prête à l'emploi!
Dessins provenant du → Lycée Clemenceau de Reims