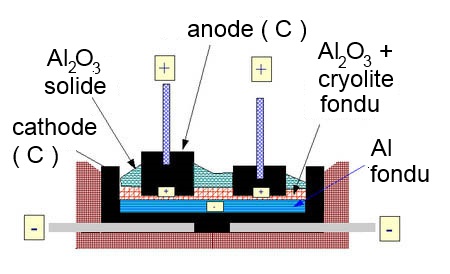
On fait l'électrolyse de la bauxite $Al_2O_3$ en bain fondu (sans eau!) entre électrodes de graphite. Quelles sont les formules des ions principaux présents?
Ions principaux présents: $Al^{3+}$ ; $O^{2-}$ provenant de la fusion de la bauxite.
Quel est l'oxydant le plus fort - le réducteur le plus fort?
$Al^{3+}$ est l'oxydant le plus fort; $O^{2-}$ est le réducteur le plus fort.
Quelles sont les réactions qui se passent aux électrodes?
À la cathode: $Al^{3+}$ $+$ $3e^-$ $\longrightarrow$ $Al$ $2H^{+}$ $+$ $2e^-$ $\longrightarrow$ $H_2$ (réductions) À l'anode: $2O^{2-}$ $-$ $4e^-$ $\longrightarrow$ $O_2$ (qui réagit avec $C$ de l'électrode pour former $CO_2$) (oxydation)
C'est le procédé industriel de fabrication de l'aluminium. Pour travailler à des températures raisonnables, on ajoute 10% de cryolithe $NaAlF_3$ ce qui permet de faire fondre la bauxite à température plus basse.