






Des cristaux de plomb métallique se forment et se déposent à la cathode: $Pb^{2+}$ $+$ $2e^-$ $\longrightarrow$ $Pb(s)$ Les ions plomb(II) sont réduits par des électrons fournis par générateur.
A la cathode ( électrode $\ominus$ ): Réduction
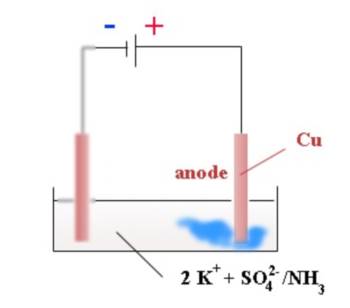
Des ions cuivre(II) se forment et se dissolvent à l'anode: $Cu$ $-$ $2e^-$ $\longrightarrow $$Cu^{2+}$ Les atomes $Cu$ de l'anode sont oxydés en perdant des électrons attirés par le générateur.
A l'anode ( électrode $\oplus$ ): Oxydation
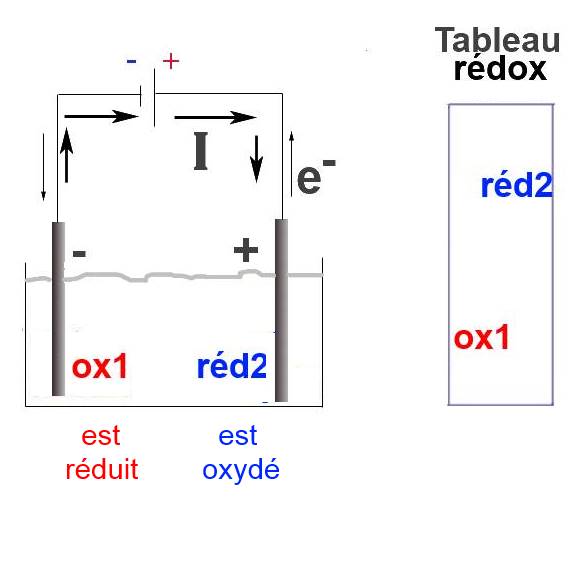
L'oxydant 1 est n'est pas assez fort pour arracher spontanément des électrons au réducteur 2.
Le générateur est une pompe d'électrons. Il force l'échange d'électrons qui ne serait pas possible autrement. À la cathode, il force la réduction de l'oxydant le plus fort qui s'y trouve (en solution ou dans l'électrode) À l'anode, il force l'oxydation du réducteur le plus fort qui s'y trouve (en solution ou dans l'électrode) Dans la solution, le courant est assuré par la migration d'ions positifs vers l'anode, d'ions négatifs vers la cathode.

Une partie de l'eau se dissocie toujours en ions hydrogène et hydroxyde: $H_2O$ $\longrightarrow H^+$ $+$ $OH^-$
Cette dissociation est très faible (une molécule sur 10000000 ! environ), mais elle suffit pour qu'on doive tenir compte des ions $H^+$ et $OH^-$ dans la prévision des électrolyses en solution aqueuse! Dans notre cas, nous sommes en présence des espèces suivantes: $K^+$ $I^-$ $H^+$ $OH^-$ $H_2O$ En consultant le tableau des couples d'oxydo-réduction, nous constatons que: $H^+$ est l'oxydant le plus fort. C'est lui qui sera réduit à la cathode: $2H^+$ $+$ $2e^-$ $\longrightarrow$ $H_2(g)$ Après disparition de l'ion hydrogène, il reste un excès d'ions hydroxyde et c'est cela qui colore la phénolphtaléine. $I^-$ est le réducteur le plus fort. C'est lui qui sera oxydé à l'anode: $2I^-$ $\longrightarrow$$ I_2$ On voit y apparaître la couleur brunâtre caractéristique du (di)iode.