





La série des tensions est le tableau d'oxydo-réduction formé par les métaux (réducteurs) et leurs cations usuels (oxydants) y inclus le couple ($H^+$/$H_2$)
$Au^{3+}+3e^-$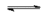 $Au$
$Hg^{2+}+2e^-$
$Au$
$Hg^{2+}+2e^-$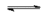 $Hg$
$Ag^{+}+e^-$
$Hg$
$Ag^{+}+e^-$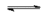 $Ag$
$Cu^{2+}+2e^-$
$Ag$
$Cu^{2+}+2e^-$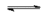 $Cu$
$Cu$
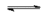
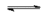 $Pb$
$Sn^{2+}+2e^-$
$Pb$
$Sn^{2+}+2e^-$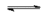 $Sn$
$Fe^{2+}+2e^-$
$Sn$
$Fe^{2+}+2e^-$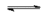 $Fe$
$Zn^{2+}+2e^-$
$Fe$
$Zn^{2+}+2e^-$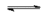 $Zn$
$Al^{3+}+3e^-$
$Zn$
$Al^{3+}+3e^-$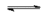 $Al$
$Mg^{2+}+2e^-$
$Al$
$Mg^{2+}+2e^-$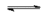 $Mg$
$Na^{+}+e^-$
$Mg$
$Na^{+}+e^-$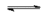 $Na$
$Ca^{2+}+2e^-$
$Na$
$Ca^{2+}+2e^-$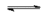 $Ca$
$K^{+}+e^-$
$Ca$
$K^{+}+e^-$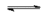 $K$
$Li^{+}+e^-$
$K$
$Li^{+}+e^-$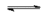 $Li$
$Li$
Chaque oxydant (à gauche) peut réagir en principe avec chaque réducteur (à droite) situé en-dessous de lui
Fer et ion cuivre(II):
 Une tige de fer plongée dans une solution de sulfate de cuivre(II) se couvre d'une couche rouge de cuivre:
$Cu^{2+}+2e^- $$\longrightarrow$$ Cu$
$Fe-2e^-$$ \longrightarrow$$ Fe^{2+}$
Une tige de fer plongée dans une solution de sulfate de cuivre(II) se couvre d'une couche rouge de cuivre:
$Cu^{2+}+2e^- $$\longrightarrow$$ Cu$
$Fe-2e^-$$ \longrightarrow$$ Fe^{2+}$
 $Cu^{2+}+Fe$$ \longrightarrow$$ Cu + Fe^{2+}$
Cuivre et ion argent:
$Cu^{2+}+Fe$$ \longrightarrow$$ Cu + Fe^{2+}$
Cuivre et ion argent:
 Une lame de cuivre plongée dans une solution de nitrate d'argent se couvre d'une couche noire d'argent:
$Ag^++e^-$$\longrightarrow$$ Ag$
$Cu-2e^-$$\longrightarrow$$ Cu^{2+}$
Une lame de cuivre plongée dans une solution de nitrate d'argent se couvre d'une couche noire d'argent:
$Ag^++e^-$$\longrightarrow$$ Ag$
$Cu-2e^-$$\longrightarrow$$ Cu^{2+}$
 $Cu +2Ag^+$$\longrightarrow$$ Cu^{2+}+2Ag$
Zinc et nitrate de plomb:
$Cu +2Ag^+$$\longrightarrow$$ Cu^{2+}+2Ag$
Zinc et nitrate de plomb:
 Des pastilles de zinc plongées dans une solution de nitrate de plomb se couvrent d'une couche noire de plomb:
$Pb^{2+}+2e^-$$\longrightarrow$$ Pb$
$Zn-2e^-$$\longrightarrow$$ Zn^{2+}$
Des pastilles de zinc plongées dans une solution de nitrate de plomb se couvrent d'une couche noire de plomb:
$Pb^{2+}+2e^-$$\longrightarrow$$ Pb$
$Zn-2e^-$$\longrightarrow$$ Zn^{2+}$
 $Zn +Pb^{2+}$$\longrightarrow $$Zn^{2+}+Pb$
$Zn +Pb^{2+}$$\longrightarrow $$Zn^{2+}+Pb$