





Quand une charge partielle δ+ réside sur un atome d'hydrogène (petit!) l'attraction entre les molécules est considérable et est parfois considérée comme une vraie "liaison".
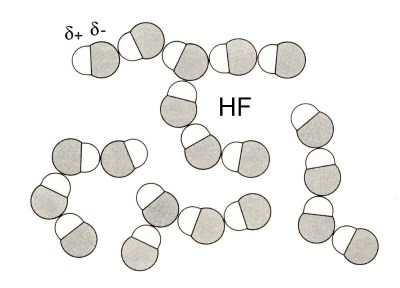 L'attraction entre les molécules du fluorure d'hydrogène est tellement forte qu'on peut considérer qu'il y a formation de "pseudo-molécules" beaucoup plus grandes.
Les ponts hydrogène jouent un rôle central en biologie moléculaire parce qu'il assurent la forme des → protéines et des acides nucléiques, comme par exemple l'→ ADN .
L'attraction entre les molécules du fluorure d'hydrogène est tellement forte qu'on peut considérer qu'il y a formation de "pseudo-molécules" beaucoup plus grandes.
Les ponts hydrogène jouent un rôle central en biologie moléculaire parce qu'il assurent la forme des → protéines et des acides nucléiques, comme par exemple l'→ ADN .
Les températures de fusion et d'ébullition des substances augmentent en général avec la masse molaire. En effet des molécules plus lourdes sont plus inertes et donc plus difficiles à mettre en mouvement. Exemple pour les alcanes non polaires:
| Alcane | téb(oC) |
| CH4 | -161,7 |
| C2H6 | -88,6 |
| C3H8 | -42,1 |
| C4H10 | -0,5 |
Regardons maintenant le diagramme suivant:
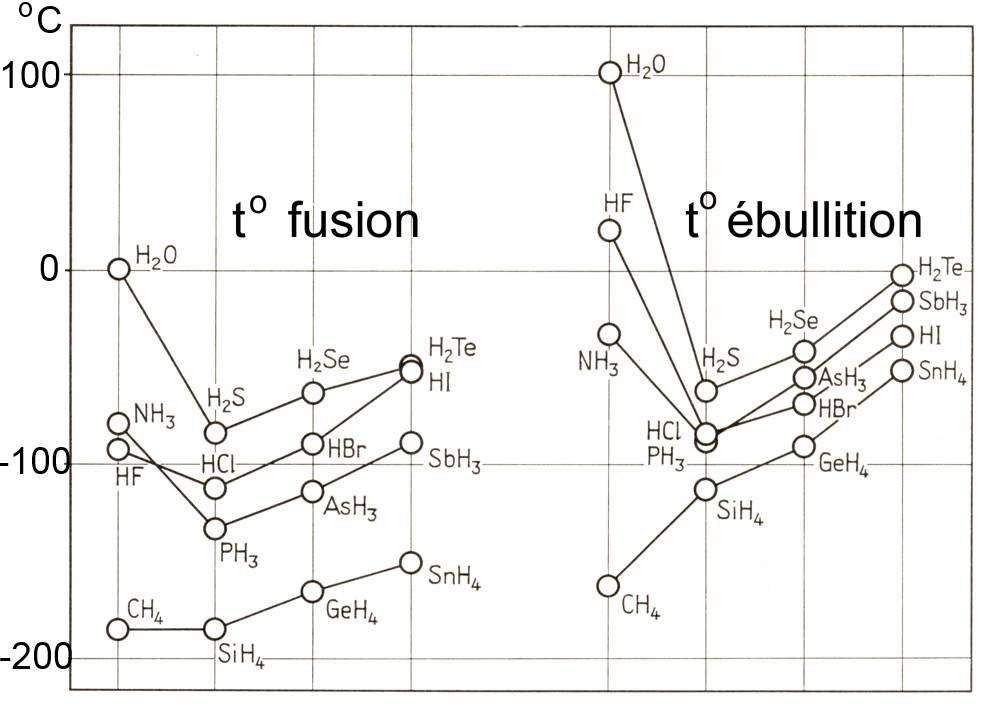 Le diagramme montre qu'en général
Le diagramme montre qu'en général
À cause de leur polarité, les substances polaires ont des températures d'ébullition et de fusion plus élevées que les substances non polaires de même masses molaires
- La température d'ébullition de l'ammoniac (polaire, structure pyramidale!) est par exemple beaucoup plus élevée que celle du méthane (apolaire, structure tétreaédrique symétrique!)
- À partir de la troisième période, les températures d'ébullition et de fusion augmentent en général aussi avec la masse molaire, par exemple
toéb(H2S)
< toéb(H2Se)
<t oéb(H2Te)
Il y a une anomalie pour les substances polaires de la deuxième période, dont les températures de fusion et d'ébullition sont très élevées au regard de leur masse molaire, par exemple
toéb(H2O)
>>toéb(H2S)
malgré une masse molaire de H2S plus grande!
Cette anomalie s'explique par les importants ponts hydrogène qu'exercent ces molécules entre elles!
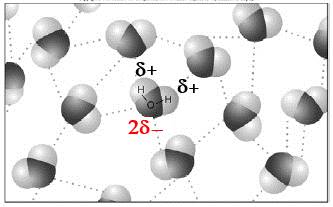 Nous devons donc le fait que l'eau est liquide à la température moyenne de notre terre uniquement à la polarité!
Nous devons donc le fait que l'eau est liquide à la température moyenne de notre terre uniquement à la polarité!
C'est grâce à la polarité que la terre est bleue!
Pour la plupart des substances, l'état solide possède une densité plus élevée que l'état liquide.
Ce n'est pas le cas pour l'eau:
Dans la glace, les ponts hydrogène forcent les molécules H2O dans un réseau hexagonal très lacunaire, donc peu dense.
 Voilà pourquoi la glace est moins dense que l'eau et elle surnage.
Si c'était l'inverse, les océans auraient toujours gelé du fond vers la surface et aucune vie n'aurait jamais pu s'y développer!
Voilà pourquoi la glace est moins dense que l'eau et elle surnage.
Si c'était l'inverse, les océans auraient toujours gelé du fond vers la surface et aucune vie n'aurait jamais pu s'y développer!
À cause de leur polarité, la glace est moins dense que l'eau liquide
C'est grâce à la polarité que la vie a pu se développer sur terre!

L'essence (formé d'alcanes non polaires) et l'eau (polaire) ne se mélangent pas (B) alors que des substances polaires comme l'alcool et l'eau (A) se mélangent.
Substance polaire et substance polaire → miscibles Substance non polaire et substance non polaire → miscibles Substance polaire et substance non polaire → non miscibles
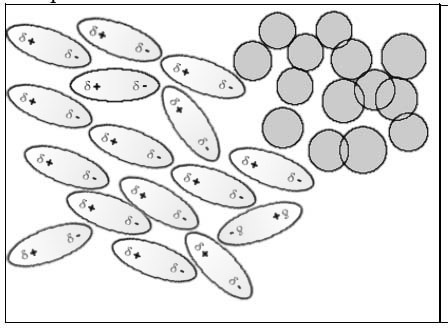
L'attraction mutuelle des molécules polaires empêche les molécules non polaires de se mélanger à elles.
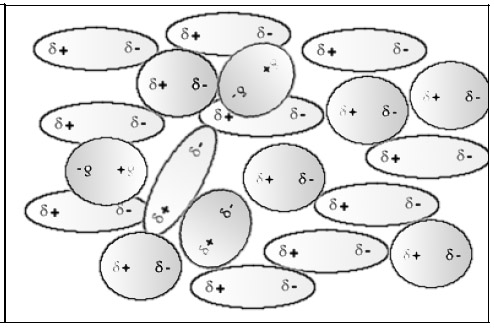 Les molécules de deux substances polaires s'attirent mutuellement et s'interpénètrent.
Les molécules de deux substances polaires s'attirent mutuellement et s'interpénètrent.
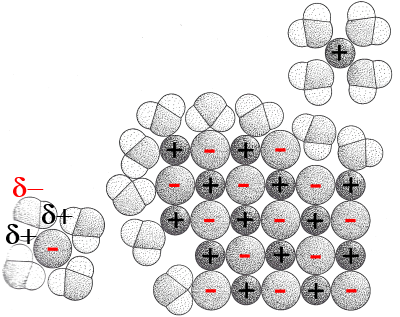
L'image montre comment se dissout un sel: Les molécules d'eau polaires se fixent autour des ions positifs (avec leurs pôles δ-) et négatifs (avec leurs pôles δ+). On dit qu'elles hydratent les ions. Les ions hydratés peuvent facilement pénétrer dans l'eau à cause de la polarité des molécules H2O qui les entourent.
Sans polarité, la soupe serait fade!
Si la cohésion des ions dans le réseau ionique est trop forte, l'hydratation suivie de la dissolution est impossible: les substances sont insolubles.
Les cations métalliques cristallisent souvent ensemble avec leurs molécules d'eau d'hydratation:

L'hydratation des cations est un cas particulier d'un phénoméne très répandu:
Des cations de petite taille s'entourent souvent de molécules polaires ou d'anions pour former des "complexes de coordination"
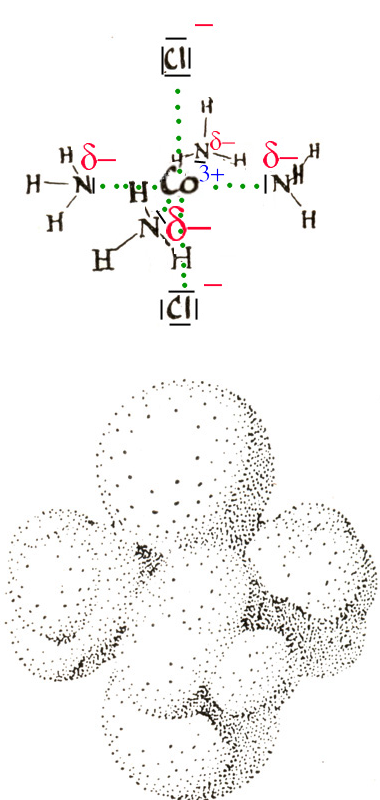
L'ion central Co3+ est entouré ici de 6 ligands: 4 molécules d'ammoniac (NH3 de structure pyramidale avec δ- sur l'atome d'azote) et de deux ions chlorure. Beaucoup de molécules importantes en biochimie sont des complexes de coordination, tels que la chlorophylle et l'hémoglobine.
Sans polarité, pas de respiration, pas de plantes vertes!
Beaucoup d'images de ce chapitres ont été empruntés à la "bible de chimie" de Linus Pauling: College Chemistry (Freeman, second edition)