





Tableau périodique → ici
Le pourcentage % d'un élément E renfermé dans une substance S est la masse de cet élément $m_E$ contenue dans 100g de substance S $\%_E = \frac{m_E \cdot 100}{m_s}$ $m_E = \frac{m_S \cdot \%_E}{100}$
Par exemple, 36,04 g d'eau renferment 32,0 g de l'élément oxygène, donc dans l'eau: $\%_O = \frac{32,0 \cdot 100}{36,04} = 88,7$
Connaissant la formule d'une substance, on peut déterminer la masse d'une mole, puis la masse d'un élément renfermé dans une mole et partant le pourcentage de cet élément:
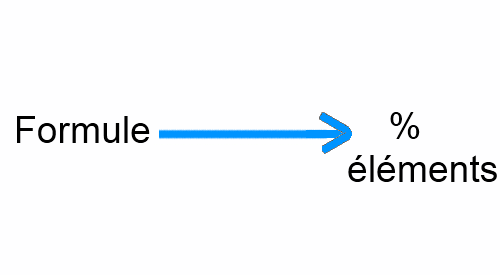
Soit par exemple le dioxyde de carbone, formule: $CO_2$: $M_{CO_2}$ $=$ $44 \frac{g}{mol}: M_C$ $=$ $12\frac{g}{mol} 2\cdot M_O$ $=$ $44-12$ $=$ $32\frac{g}{mol}$ 44g de $CO_2$ renferment 12g $C$ et 32g $O$ $\%C$ $=$ $\frac{12 \cdot 100}{44}$ $=$ $27,3$ $\%_O$ $=$ $\frac{32 \cdot 100}{44}$ $=$ $72,7$ ou encore: $\%_O$ $=$ $100-27,3$ $=$ $72,7$
Connaissant la masse molaire d'une substance et le pourcentage de ses éléments, on peut déterminer le nombre de moles de chaque élément présents dans une mole de la substance et partant la formule de la substance:
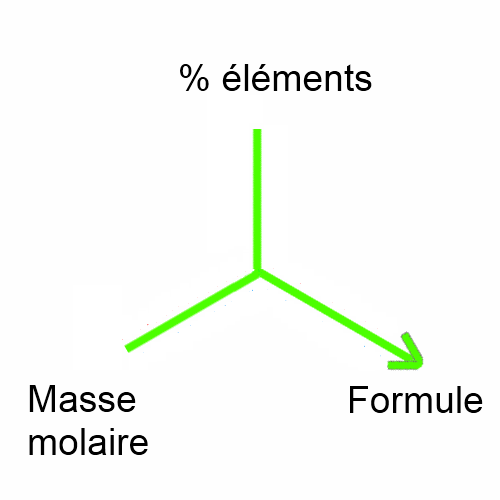
Soit par exemple une substance renfermant 27,3% C et 72,7% O et de masse molaire M$ $=$ $44 $\frac{g}{mol}$: Dans 44 g de la substance, il y a $\frac{27,3 \cdot 44,3}{100}$ $=$ $12,0$ g de l'élément C et $\frac{72,7 \cdot 44,3}{100}$ $=$ $32,0$ g de l'élément O Dans 1 mole de la substance, il y a $\frac{12}{M_C}$ $=$ $1$ mole de l'élément C et $\frac{32}{M_O}$ $=$ $2$ mol de l'élément O Dans $6\cdot 10^{23}$ molécules de la substance, il y a $6\cdot 10^{23}$ atomes de l'élément C et $2\cdot 6\cdot 10^{23}$ atomes de l'élément O Dans 1 molécule de la substance, il y a 1 atome de l'élément C et 2 atomes de l'élément O Formule de la substance: $CO_2$